- 网站首页
- 学校概况
学校简介校园风光校园视频学校发展领导之窗组织机构校史沿革规章制度
- 校园动态
校园新闻公示公告招生招聘周程安排
- 教学科研
科研动向课题研究课程设置队伍建设课例展示资源下载教学视频
- 教务管理
成绩查询教务快讯资源下载
- 德育空间
专题教育德育队伍德育活动学子风采德育课程德育在线心灵驿站爱国主义班主任信息资源库
- 体艺之窗
- 党政建设
党员风采支部建设党的群众路线教育实践活动政策文件
- 工会工作
法律法规调研文章工会要闻
- 校报校刊
- 附属幼儿园
幼儿园动态领导机构幼儿园简介
- 职称专题
- 团委
资助信息学生会社团联合会一般新闻
- 名师榜
龙湾校区龙岗校区
- 名师工作
语文工作坊梁小金工作室何萍工作室
高考一轮复习 《氯及其化合物》
高考一轮复习 《氯及其化合物》
第一、二课时
陆 洁
【考纲解读及复习重点】
1、Cl2的结构、性质、制备及重要用途;
2、氯水的成分与主要性质;
3、氯气实验室制法( 装置、净化、收集、尾气处理等问题 )
【知识与技能】
1、掌握氯气的化学性质。并能用氧化还原反应的观点解释Cl2的性质;
2、氯气实验室制法( 装置、净化、收集、尾气处理等问题 ) ;
3、次氯酸的性质(不稳定性、酸性、氧化性、漂白性)。
【过程与方法】
1、以氯气为中心,写出常见的含氯物质并用线条表示出其相互关系。
2、以氯气为例,掌握元素单质及其化合物的学习思路,把所学知识系统化,同时把基础理论、化学实验等有机结合起来。
3、通过在数轴上表示出氯元素的价态,并写出对应价态下的常见物质,学会利用价态的思路复习元素化合物。
【教学过程】
|
教师活动 |
学生活动 |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
【板书】氯及其化合物 (建网思路指导)可根据元素化合价
【PPT】 考纲解读 明确复习重点 |
听讲、思考 |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
指导学生自行完成《优化设计》基础知识的梳理一及归纳突破一 |
阅读相关内容、填写相关知识并及时记忆 |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
【板书】列知识提纲 氯气
反应条件 方程式 现象
|
|||||||||||||||||||||||||||||||||||||||||||||||||||
|
指导学生整理知识网络 |
学生代表描述相关知识 全班同学听讲并及时补充 |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
【ppt】考点分析点拨
|
听讲 |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
【ppt】一、有关氯气的性质考查 思考一: 1、如何鉴别集气瓶中的气体是氧气还是氯气? 2、收集满氯气的集气瓶盖好玻璃片后是正放或倒放在桌面上,理由? 3、如何闻氯气的气味? 思考二: 1、氯气泄漏处理方法和过程较合理的是 ①③ 。 ①及时转移疏散人群,同时向有关部门如实报告事故的有关情况; ②被转移人群应戴上用浓NaOH处理过的口罩; ③被转移人群可戴上用Na2CO3处理过的口罩(湿润); ④将人群转移到地势较低的地方; ⑤常温下氯气能溶于水,所以只要向空气中喷洒水就可以解毒。 2、下列有关氯气的叙述正确的是( ) ①氯气的水溶液可以导电,说明氯气是电解质 ②纯净的氢气可以在氯气中安全燃烧,发出苍白色火焰 ③钠和磷都可以在氯气中燃烧,都产生白色烟雾 ④铜在氯气中燃烧,产生白烟,加水溶解后可得蓝绿色溶液 ⑤铁能与氯气发生反应,所以不能用钢瓶储存氯气 3、将0.03 mol Cl2缓缓通入含0.02 mol H2SO3和0.02 mol HBr的混合溶液中,在此过程溶液的c(H+)与Cl2用量的关系示意图是(溶液的体积视为不变) ( A )
|
思考,讨论,回答问题 |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
【ppt】二、氯水的相关问题考查 新制氯水、久置氯水、液氯比较
|
阅读《优化设计》归纳突破二 3 思考完成ppt上的相关表格 学生回答 |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
【思考练习】 《优化设计》P33即时训练4、1 P35巩固提升1 下列有关化学反应过程或实验现象的叙述中,正确的是 ( ) A.氯气的水溶液可以导电,说明氯气是电解质 B.为证明氯水中含Cl-,可先加盐酸酸化,再加入AgNO3溶液 C.氯气可以使湿润的有色布条褪色,但实际起漂白作用的物质是次氯酸而不是氯气 D.漂白粉和明矾都常用于自来水的处理,二者的作用原理是相同的
|
思考,回答问题 |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
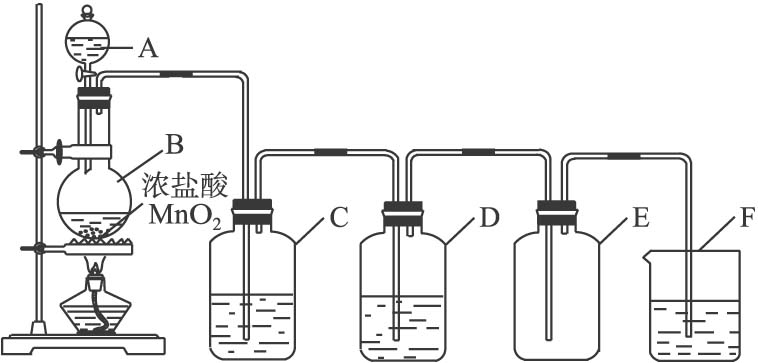
【ppt】氯气的制备 1、工业制法 ①电解饱和食盐水: ②电解熔融NaCl : 2、实验室制法 (1)反应原理: MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O (2)实验装置
发生装置——净化装置——收集装置——尾气处理装置 ①制备: ②除杂:用饱和食盐水除去HCl ③干燥:用浓硫酸干燥 ④收集:向上排空气法 (或排饱和食盐水法) ⑤验满:湿润的淀粉碘化钾试纸 ⑥性质验证: ⑦尾气处理:用碱液吸收 (3)实验步骤:检密—装药—固定—加热—收集
|
师生共同总结 |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
【思考】
|
分组讨论,思考回答 |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
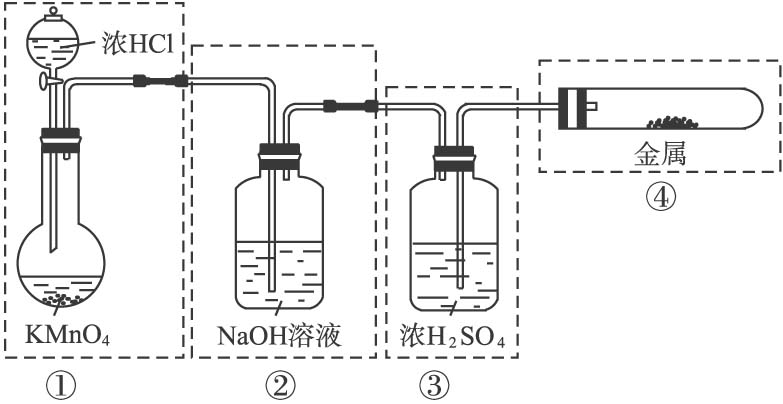
【练习】已知KMnO4与浓HCl在常温下反应能产生Cl2。若用图所示的实验装置来制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是( )
A.①和②处 B.只有②处 C.②和③处 D.②③④处 《优化设计》P35 巩固提升 5 |
思考,解答 |
||||||||||||||||||||||||||||||||||||||||||||||||||
|
小结本课 |
学生小结 |
- 相关信息
- 没有相关内容
 《乙酸》教学设计[ 02-01 ]
《乙酸》教学设计[ 02-01 ] 化学一轮复习教案 《化学平衡》[ 02-01 ]
化学一轮复习教案 《化学平衡》[ 02-01 ]